疫苗事件新进展,局长落马,15人被刑拘,45家疫苗企业面临彻查;一致性评价新声音,打破一品两规
2018-07-31 08:37 来源:网友分享
上周热点,国家药监局发布了原辅包登记和关联审评细则、《中药材生产质量管理规范(修订草案征求意见稿)》;闹的全国人心惶惶的疫苗事件有了新进展;一致性评价第十五批新鲜出炉,打破一品两规新声音浮出水面,下面一起来看看:
总局要闻
一 原辅包登记和关联审评细则发布
7月24日,国家药监局发布《关于药品制剂所用原料药、药用辅料和药包材登记和关联审评审批有关事宜的公告(征求意见稿)》,明确已纳入中国药典、美国药典、欧洲药典、日本药典和英国药典的非高风险药用辅料以及已有国家标准的非高风险药包材等五种情形可自主选择是否登记。除此之外,其他药用辅料和药包材均需要在制剂提出上市申请前按照有关要求登记等。
二《中药材生产质量管理规范(修订草案征求意见稿)》发布
7月23日,国家市场监督管理总局发布《中药材生产质量管理规范(修订草案征求意见稿)》。此次修订主要遵从五个方面的思路:强调对中药材质量有重大影响的关键环节实施重点管理的同时,重视全过程细化管理,树立风险管控理念;以高标准、严要求作为《规范》修订出发点,兼顾中药材生产的现实情况和当前技术水平等。
疫苗事件最新进展
一 吉林食药监局长落马
7月26日,吉林省食品药品监督管理局原党组书记、局长崔洪海(正厅级)涉嫌受贿罪一案,由长春市人民检察院向长春市中级人民法院提起公诉。长春市人民检察院起诉书指控:被告人崔洪海利用职务便利,为他人谋取利益,非法收受他人财物,依法应当以受贿罪追究其刑事责任。
二 长生生物15人被刑拘
长生生物涉案人员扩大到15人。7月24日,据长春公安宣传消息,长生生物董事长高某芳等15名涉案人员被依法刑事拘留。
三 长生生物实施其他风险警示,简称加ST
7月24日晚间,长生生物(002680)发布公告称,7月25日公司股票停牌一天,自7月26日开市起被实施其他风险警示,公司股票简称由“长生生物”变更为“ST长生”,公司股票代码为“002680”,公司股票交易日涨跌幅限制为5%。据悉,一只股票名字加上st主要是给股民一个警告,该股票存在投资风险。
四 国家药监局将彻查全国45家疫苗企业
7月22日,国家药监局部署了对全国疫苗生产企业进行全面检查,7月25日起,在2018年年初对全国45家疫苗生产企业全覆盖跟踪检查的基础上,组织全国监管力量,派出检查组对全部疫苗生产企业原辅料、生产、检验、批签发等进行全流程、全链条彻查,保障人民群众用药安全。据药智国产药品数据库显示,45家生产单位名单如图1。另外,据统计,获得批件排名前十的有兰州生物、武汉生物、北京北生研生物等(具体详情如图2)。

(图一)
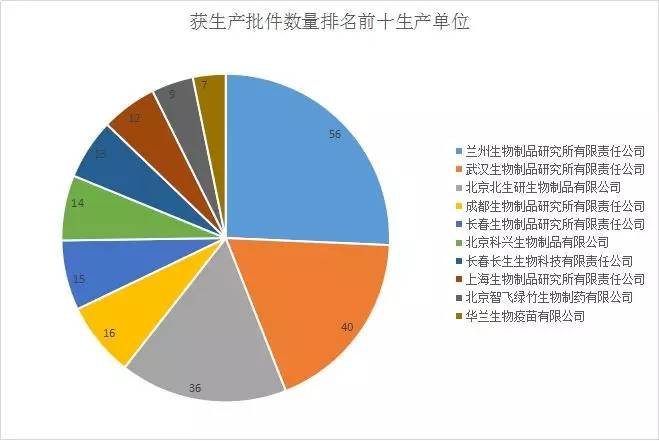
(图二)
一致性评价新进展&新声音
一 第五批一致性评价名单出炉,5个289目录产品在列
截止7月27日,一致性评价申报受理号共计264个,涉及114家企业的109个品种。本周(7月20日至27月)一致性评价工作喜讯连连:第五批通过一致性评价名单出炉,涉及12家企业的8个品种,其中包含289目录品种5个,分别是蒙脱石散、卡托普利片、阿法骨化醇片、苯磺酸氨氯地平片和头孢呋辛酯片,其中浙江海正的瑞舒伐他汀钙片第3家通过一致性评价;此外,齐鲁制药的盐酸特比萘芬片即将首家通过一致性评价;而在本周新承办动态中,新增了13个一致性评价受理号,涉及11家企业的12个品种。
一 行业资深人士:仿制药政策落地,一品两规是束缚
“一品两规”,源出于卫生部2007年2月14日发布,当年5月1日起施行实施的《处方管理办法》第十六条:医疗机构购进药品,同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1-2种,因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外。
有行业资深人士表示,国家政策明确,招标采购只选用首先通过一致性评价的3个药品;又鼓励医疗机构优先采购使用;国家卫健委的一位官员也讲“仿制就是为了替代。”如果要做到这一点,首先就要摒弃“一品两规”的限制。
二 浙江先行,79个仿制药采购突破一品两规
近日,浙江省药械采购平台发出公示,关于部分通过质量和疗效一致性评价仿制药拟挂网采购产品,公示目录共涉及79个品规,包括:石药集团的阿奇霉素片、华海药业的缬沙坦片、成都倍特的头孢呋辛酯片、正大天晴的瑞舒伐他汀钙片等多款重磅产品。据今年5月,浙江省药械采购中心发布的《关于通过质量和疗效一致性评价仿制药直接挂网采购的通知》中显示,医疗机构在2018年底之前,可临时突破《处方管理办法》中有关使用药品一品两规的规定,增加采购使用通过一致性评价的产品。
三 山东:通过一致性评价药品,允许提价、不受中标产品数量限制
7月26日,山东卫计委发布《关于山东省公立医疗卫生机构药品和高值医用耗材集中采购工作有关问题的通告》(以下简称《通知》)。对通过一致性评价的药品,在招标采购环节,开了绿灯——和原研同组竞价,允许提价。《通知》表示,对纳入公开招标目录范围内且通过仿制药质量和疗效一致性评价的药品(以国家药品监管部门核发的批准证明文件为准),列入第一竞价组,不受中标产品数量限制。
四 第十六批仿制药参比制剂目录发布
7月26日,国家药监局发布仿制药参比制剂目录(第十六批)的通告。具体包括,礼来(Lilly)的他达拉非片(TadalafilTablets/CIALIS,规格:20mg,10mg,2.5mg)等7个原研进口制剂,SandozGmbH公司的青霉素V钾片这一国际公认进口制剂。据统计,从2017年3月17日发布仿制药参比制剂目录(第一批),截至目前,国家药监局共发布16批仿制药参比制剂目录。不同规格计算在内,共1097个。
信息来源:国家药监局、赛柏蓝、E药经理人等。
















 1
1 2
2 3
3 4
4 5
5