转移性肝癌声像图表现 如何治疗转移性肝癌
2018-05-05 07:27 来源:网友分享
一、转移性肝癌的病因
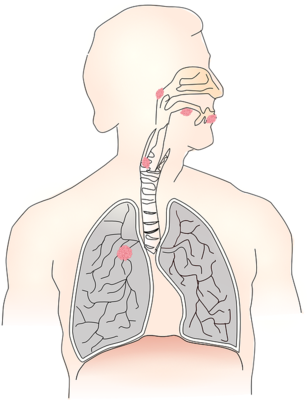
全身各脏器的癌肿几乎均可转移至肝脏,恶性肿瘤可以向周围组织直接浸润,或侵入淋巴管,血管及体腔,之后癌细胞随淋巴液,血液及各种腔道转移至远处,癌细胞的浸润及转移主要取决于其本身的恶性生物学特性及机体免疫状态,癌细胞具有阿米巴样活动能力,能自主地向周围组织浸润和运动;癌细胞之间黏着力下降使其具有易脱落倾向,增加了转移的机会;癌细胞高表达某些整合素可能赋予癌细胞迁移的动力,使其易于穿透基底膜;机体某些黏附分子(adhesive molecule)有助于癌细胞在转移脏器中的滞留;癌细胞表面蛋白水解酶活力的增高也有利于其浸润和转移,由于荷瘤宿主大多存在机体免疫功能低下,不能有效识别和杀伤转移的癌细胞,一旦癌细胞在远处脏器停留,可释放多种生长因子及其受体,如血管内皮细胞生长因子(VEGF),使癌细胞自主性无限制生长,癌细胞的这种恶性生物学特性与其所携带的遗传信息,如DNA倍体或干系水平有一定关系,异倍体的癌细胞较二倍体的癌细胞更易发生转移,肝脏由于本身解剖及血供的特点,可能更易给多种癌细胞提供滞留的生长空间和营养来源。
人体各部位癌肿转移至肝脏的途径有门静脉,肝动脉,淋巴路和直接浸润4种。
二、转移性肝癌的种类

1. 门静脉转移
凡血流汇入门静脉系统的脏器,如食管下端,胃,小肠,结直肠,胰腺,胆囊及脾等的恶性肿瘤均可循门静脉转移至肝脏,这是原发癌播散至肝脏的重要途径,有报道门静脉血流存在分流现象,即脾静脉和肠系膜下静脉的血流主要进入左肝,而肠系膜上静脉的血流主要汇入右肝,这些门静脉所属脏器的肿瘤会因不同的血流方向转移至相应部位的肝脏,但临床上这种肿瘤转移的分流情况并不明显,而以全肝散在性转移多见,其他如子宫,卵巢,前列腺,膀胱和腹膜后组织等部位的癌肿,亦可通过体静脉或门静脉的吻合支转移至肝;也可因这些部位的肿瘤增长侵犯门静脉系统的脏器,再转移至肝脏;或先由体静脉至肺,然后再由肺到全身循环而至肝脏。
2. 肝动脉转移
任何血行播散的癌肿均可循肝动脉转移到肝脏,如肺,肾,乳腺,肾上腺,甲状腺,睾丸,卵巢,鼻咽,皮肤及眼等部位的恶性肿瘤均可经肝动脉而播散至肝脏,转移至肝脏者也较常见。
3. 淋巴路转移
盆腔或腹膜后的癌肿可经淋巴管至主动脉旁和腹膜后淋巴结,然后倒流至肝脏,消化道癌肿也可经肝门淋巴结循淋巴管逆行转移到肝脏,乳腺癌或肺癌也可通过纵隔淋巴结而逆行转移到肝脏,但此转移方式较少见,临床上更多见的是胆囊癌沿着胆囊窝的淋巴管转移到肝脏。
4. 直接浸润
肝脏邻近器官的癌肿,如胃癌,横结肠癌,胆囊癌和胰腺癌等,均可因癌肿与肝脏粘连由癌细胞直接浸润而蔓延至肝脏,右侧肾脏和肾上腺癌肿也可以直接侵犯肝脏。
三、转移性肝癌的发病机制

肝脏是极为适宜于肿瘤细胞生长的器官,其中又以胃肠道肿瘤最易发生肝转移,这与肝脏接受门静脉系统的血液灌流有关,至于肝脏如何成为转移癌最常发生的器官,绝不仅是血液丰富和淋巴引流所致,其内在机制尚未明了,癌细胞的转移是多步骤的复杂过程,包括原发灶癌细胞脱落,透过脉管壁,进入血循环或淋巴系统后的生存,选择着床组织或器官,着床后癌细胞生长分裂形成转移灶等,肝脏的细微结构亦可能对发生肿瘤产生影响,肝脏血流经肝窦,窦内皮细胞和Kupffer 细胞起到将癌细胞驻留的作用;肝脏丰富的双重血液供应亦有助于转移癌细胞栓子取得营养供应,而肝窦内皮细胞的特点是具有大小不一的孔隙;肝窦内尚有Kupffer 细胞,它的特点是善于捕捉肝窦血流中的颗粒性物质,拦阻血流中肿瘤细胞的去路,伴随着Kupffer 细胞的血小板更有助于将肿瘤细胞捕捉,肿瘤细胞若要能生存下来,必须穿过肝窦内皮细胞层达到Disse 间隙,否则便会被Kupffer 细胞包围和消灭,在Disse 间隙,该处为肿瘤细胞的生长提供了优良生长条件,既有从 肝窦血流来的富于营养素的滤过液,又无其他细胞的对抗和干扰,因而肝脏内转移灶的发展往往比其他部位的转移灶快得多,当发生肝转移时,病人亦往往首先由于肝转移而危及生命。
现认为肿瘤细胞经过约20次倍增,可达到直经1mm,约100万个细胞数时,即具有转移的能力,此时肿瘤结节还难于被现代先进影像检查所发现,可见要发现一个真正的原位癌,特别是像肝脏那样深在的器官是十分困难的,当肿瘤结节再行20~80次的倍增时,才可能被现代的检查方法所发现,因而当早期发现肿瘤结节时,实际上肿瘤已存在数月至数年的时间,在这段时间内肿瘤已具备转移的能力。
动物实验提示,每克肿瘤组织,每24小时内可有400万个肿瘤细胞脱落,可成为转移的源泉,但是其中90%的肿瘤细胞很快便在循环中消失,99%以上会很快死亡,故转移亦非均为有效,它取决于身体的防御能力,局部条件,肿瘤细胞生物学特性等多种因素,脱落至循环中的肿瘤细胞,大部分是分散的,不到0.1%有可能聚合形成细胞团块或瘤栓,后者能在新的部位建立起转移灶的机会要比分散的细胞高得多,在建立转移灶之际,肿瘤细胞需要穿过微血管内膜至血管周围,当肿瘤结节达到1~3mm时,就须建立其自身的血管供应,以维持不断增殖的需要,并且转移灶又可成为新的转移源泉,若无足够的血循环建立,肿瘤细胞仅靠营养素的扩散来维持时,则肿瘤细胞在繁殖与死亡间取得平衡,肿瘤即保持1~3mm的大小而不致增大。
四、转移性肝癌的治疗

近年来,继发性肝癌的治疗有了较大进展。由于随访制度的完善,新的影像检查技术的应用和血清标记物的检测,继发性肝癌患者获得早期诊断和早期治疗的机会增多,其生存率得到了相应的提高。在继发性肝癌的治疗同时需结合原发灶的治疗。目前治疗方法有手术切除、化疗、肝动脉栓塞化疗和生物治疗等。
1. 手术治疗
(1)手术治疗的指征:
①原发癌可切除或已切除者。
②转移癌结节是单个或局限于一叶内。
③肝脏转移灶估计是体内惟一的残余癌。
④病人的一般情况较好,心肺肾的功能能耐受手术。
(2)手术方法:主要有肝叶切除术和肝动脉结扎术。美国有学者报告,在有3个或3个以下转移灶的患者中,如转移灶被切除且切缘干净,5年生存率可达30%~40%,肝转移的复发率小于20%;对于肝转移灶在4个或4个以上者,如采取肝脏病灶切除术,罕有生存至3年的,而且肝内病灶通常会有所增加。
肝切除术:除类癌外,在无肝外转移的情况下,应尽可能切除所有可见的肝转移病灶。一般认为结直肠癌肝转移是最好的适应证。此外,Wilm肿瘤、平滑肌肉瘤及视网膜黑色素瘤的继发性肝癌经肝切除后也有较好的疗效。不同的方式,术后生存期不尽相同。Logan等(1982)统计肝脏楔形或局部切除后平均生存期为45个月,左肝叶或右肝叶切除为24个月,右半肝切除仅11个月。Rafpal(1982)极力主张肝切除距离肿瘤需在2cm以上,否则宁可选择肝叶切除而不作局部切除。他报道14例切缘小于2cm的中位生存期为25个月,另14例切缘超过2cm者为51个月。Forther(1984)将继发性肝癌分为3期:Ⅰ期者肿瘤局限于肝切除部分;Ⅱ期者肿瘤有局部扩散或直接侵犯较大血管或胆管;Ⅲ期者肿瘤有淋巴结、腹腔或远处转移。Ⅰ期患者的术后生存期较Ⅱ~Ⅲ期者明显延长。总之,约有20%~30%的患者肝切除后可延长生存期并改善生活质量。因此若无禁忌证,局部继发性肝肿瘤切除术应视为首选的治疗方法,切缘距离肿瘤至少2cm。如继发性肝癌较大,可在结直肠癌切除术后4~6周进行肝切除。继发性肝癌的手术并发症主要为感染和肝功能衰竭,病死率约为4%~20%。发生原因与肝切除的范围、术中出血量以及手术对组织的损伤等因素相关。对于肝硬化者一般不作肝切除手术。
2. 肝动脉灌注化疗(HAI)
Bterman 等(1950)首创本法治疗,20 世纪60 年代方引人注目,直至70 年代由于操作技术日臻完善和并发症明显减少而被广泛采用。但是所用药物的选择、适应证以及给药方案等问题仍无定论。目前认为HAI可用于不能切除的无肝外病变或肝外病变较小的肝转移癌患者。禁忌证为肝肿瘤病变广泛,伴有黄疸、腹水或一般情况较差者。如有骨转移和中枢神经系统症状,则属绝对禁忌。由于大多数肝转移癌几无症状,或有症状亦较轻微,故应将延长生存期作为HAI 治疗是否成功的主要指标。
本疗法的理论基础是在解剖学上观察到大多数肝转移癌系肝动脉供血,因此HAI 可有选择性地杀伤肿瘤细胞。结直肠癌肝转移常用的较为有效的抗癌药物是氟尿嘧啶(5-FU)和氟尿苷(FUDR),两者长期持续给药较间断给药能获得更好的疗效。HAI 的优点是全身的不良反应少,但有肝毒性反应。除引起黄疸和肝功能损害外,尚有迟发性胆汁性肝硬化的报道。导管经腹插入可观察肝转移病变的全貌,置管位置确实,固定牢靠;而经皮者导管容易滑落,药物灌注不够充分满意,可能引起胃肠刺激反应,同时也易发生感染和败血症。















 1
1 2
2 3
3 4
4 5
5